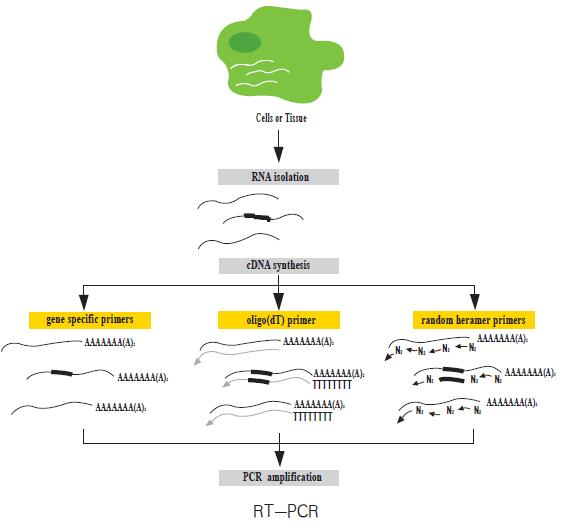
简 介
傻瓜RT-PCR反应体系包含了进行逆转录 mRNA 为cDNA及PCR扩增DNA的各种反应物,两步反应在同一管中进行。
优势与特色
时效性:显著缩短建立反应所需的时间。
稳定性:傻瓜逆转录反应体系包含有逆转录酶稳定剂,所以逆转录酶的活力和稳定
性是极其有保障的。若贮存在-20℃有效期达2年,室温贮存稳定性超过一个月,95℃为20分钟,预变性对酶活性无影响。
准确性:在大批量反应中,傻瓜逆转录反应体系在数千次反应体系中都能得到一致的结果,严格的功能质量检测显示出高度的一致性,与标准反应相比产物量更高。
简易性:每个管中都含有指示染料和沉淀剂以便琼脂糖凝胶电泳,并省略了样品与上样缓冲液混合等步骤。
防污染:在常规RT/PCR实验中,由于反复冻融和抽取,可能导致试剂的浪费和交叉污染,增加出错的几率,使用本系统则最大限度地减少此类问题的发生。
实验方法
1. 据下表将适当浓度的模板RNA和反向引物混合在DEPC处理过的管中。
模板RNA和引物在反应体系中的用量 :
| 反应体系 |
20µl反应体系 |
| 模板RNA |
总RNA |
0.5~1.0µg |
| Poly(A)RNA |
0.05~0.1µg |
| 引物 |
上游引物 |
10~30 pmol |
| 下游引物 |
10~30pmol |
2. 将其70℃温育5分钟后放置冰上。
3. 将其和正向引物加入到傻瓜RT-PCR反应管中,并用DEPC处理水补足到相应的反应体积。
4. 通过振荡将冻干物完全溶解,然后短暂离心。
5. 加少许矿物油(若使用带加热盖的PCR仪,可省略此步骤)。
6. 根据下列推荐的条件进行cDNA合成
42℃,60分钟(cDNA合成)
94℃,5分钟(反转录酶失活)
目录号 |
品名及规 格 |
价格 |
| FRTP-2.5 |
25管,0.5ml薄壁管,20µl体系 |
620元 |
| FRTP-2.2 |
25管,0.2ml薄壁管,20µl体系 |
620元 |
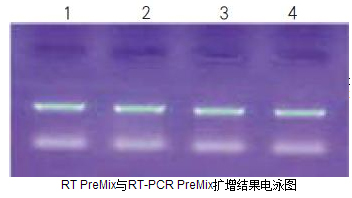
RT PreMix与RT-PCR PreMix扩增结果电泳图
1、2泳道为RT PreMix合成cDNA后的扩增结果 (扩增片段1.5kb);
3、4泳道为RT-PCR PreMix的扩增结果 (扩增片段1.5kb)。
常见问题及参考意见:
1. RNA结构特点及RNase的作用? RNA是由4种(2'未脱氧的)核苷酸A、U、 G、C的单链构成的聚合物。2'-OH对RNA分子
的理化性能有重要影响:
(1)RNase对RNA的降 解作用通过2'-OH进行,不再需要DNase必须的 工作金属离子的参与便可完成;
(2)RNA分子在 强碱条件下,通过2'-OH参与形成2'、3'磷酸二 酯(环)自发水解,因此在无RNase的水溶液中 其稳定性也远远低于DNA;
(3)RNase为较小的单肽链蛋白,尤其是具有较多的二硫键(4对), 使得RNase的结构特别紧凑,100℃ 20分钟也不
会失活,高压灭菌也不会使之变性。因此,RNA 极易受RNase的攻击而降解,导致实验失败。
2. 操作RNA注意事项?
由于RNA 酶的高稳定性、广泛存在性和 RNA的不稳定性,在有关RNA操作的实验中须 十分小心。
(1)指定特定的区域作为操作RNA专用区,保持实 验室低温、清洁的环境,减少空气流动,实验 前用RNA酶灭活剂和75%乙醇擦拭实验台。
(2)实验过程中需戴口罩及一次性手套,接触可能 污染RNA酶的物品后要更换手套。
(3)对于内源RNase的抑制,根据实验特点采取不 同方法。如体外转录、合成cDNA第一链等实 验,加入RNase的专一抑制剂(RNasin);对于
RNA的分离制备采用非特异的蛋白变性剂,如 异硫氰酸胍-巯基乙醇联合变性的方式等。
(4)对于外源RNase,凡不能用高温烘烤的材料如 塑料容器等,通常用0.1% 的焦碳酸二乙酯(DEPC)水溶液37℃浸泡12小时以上,高温灭
菌并烘干后使用。DEPC是RNA酶的化学修饰 剂,它和RNA酶的活性基团组氨酸的咪唑环反 应而抑制酶活性。所用玻璃器皿需置于干燥烘
箱中200℃烘烤2小时以上或180℃烘烤12小时 以上,冷却备用。 实验所用试剂也可用DEPC 处理,加入 DEPC至0.1%浓度,然后剧烈振荡10分钟,再
煮沸15分钟或高压灭菌以消除残存的DEPC, 否则DEPC也能和腺嘌呤作用而破坏mRNA活 性。配制的溶液如不能高压灭菌,可用DEPC处
理水配制,并尽可能用未曾开封的试剂。注意: DEPC与氨水溶液混合会产生致癌物,因而使 用时需小心。DEPC能与胺和巯基反应,因而含 Tris和DTT的试剂不能用DEPC处理。
(5)用作RNA分析的电泳槽要用1%SDS清洗,用 水冲洗后,然后用无水乙醇清洗,最后用3%双 氧水浸泡10分钟。使用前再用DEPC处理水冲 洗电泳槽。
3. cDNA产量很低,为什么?
可能的原因:
(1)RNA模板质量低;
(2)对 mRNA浓度估计过高;
(3)反应体系中存在反转 录酶抑制剂或反转录酶量不足;
(4)反应体积过 大,一般不应超过50μl。
4. 进行RT-PCR实验时,产生弥散条带,为什么?
(1)在PCR反应体系中第一条链产物的含量过 高;
(2)引物的用量过高;
(3)没有优化PCR反 应条件及循环参数;
(4)在用DNase处理被DNA 污染的RNA样品时,其产生的寡核苷酸片段会产 生非特异性扩增,一般会显示为弥散背景。
5. 进行RT-PCR实验时,在琼脂糖凝胶分析中看到少量或没有RT-PCR产物,为什么?
可能原因 |
建议解决方法 |
| RNA被降解 |
在变性胶上验证RNA的完整性 |
| 使用无污染技术分离RNA |
| 将组织从动物体取出后立即处理 |
| 在100%甲酰胺中储存RNA |
如果使用胎盘RNase抑制剂,不要加热超过45℃或pH超过8.0,否
则抑制剂会稀释所有结合的RNase |
| RNA中包含逆转录抑制剂 |
通过乙醇沉淀RNA,然后用70%(v/v)乙醇对RNA沉淀进行漂洗。逆转录抑制剂包括:SDS、EDTA、甘油、焦磷酸钠、亚精胺、甲酰胺
和胍盐 |
| 将对照RNA同样品混合,与对照RNA反应比较产量以检测抑制剂 |
| 多糖同RNA共沉淀 |
使用氯化锂沉淀RNA以除去多糖 |
| 用于合成cDNA第一链的没有很好退火 |
确定退火温度是否适合您的Oligo DNA。对于随机六聚体,Oligo DNA建议在反转录保温之前先在25℃保温10分钟 |
对于基因特异性Oligo DNA(GSP),可以试用一下其他GSP,或换
用oligo(dT)或随机六聚体确定GSP是反义序列 |
| 起始RNA量不够 |
增加RNA量 |
对于<50ng的RNA样品,可以在第一链cDNA合成中使用0.1μg到
0.5μg乙酰BSA |
| RNA模板二级结构太多 |
将RNA和Oligo DNA在不含盐及缓冲液条件下变性、退火
提高逆转录反应温度 |
| 靶序列在分析的组织中不表达 |
尝试其他靶序列或组织 |
| PCR没有起作用 |
对两步法RT-PCR,不要在PCR步骤中使用超过1/5的逆转录反应
产物 |
| PCR Oligo DNA设计较差 |
避免在Oligo DNA3'端含有互补序列 |
| 避免可以形成内部发卡结构的序列 |
| 设计Tm值接近的Oligo DNA |
| 目的序列不在目的RNA上 |
重新设计实验,或尝试用其它来源的目的RNA |
| 模板GC含量太高 |
对于GC含量>50%的模板,使用改善GC含量的优化剂 |
| 模板浓度太低 |
使用103拷贝的靶序列,以在25到30个循环中获得信号 |
| 镁离子浓度太低 |
从1~3mM间隔0.5mM进行一系列反应,确定对于每个模板和
镁离子浓度太低Oligo DNA对的最佳镁离子浓度。注意:对于Real Time PCR,
使用3~5mM的镁离子浓度 |
| 退火温度太高 |
将退火温度设定为低于Tm值5℃进行PCR反应,真正的退火温度
实际会高些或低些 |
| Oligo DNA浓度太低 |
最佳Oligo DNA浓度介于0.1μM到0.5μM之间 |
| 特异Oligo DNA(GSP)设计较差 |
遵循Oligo DNA设计原则 |
6. 进行RT-PCR实验时,在琼脂糖凝胶分析中看到非特异性扩增产物,为什么?
可能原因 |
建议解决方法 |
反应条件不是最佳 |
优化镁离子浓度及退火温度 |
| 使用镁离子前将其震荡混匀 |
引物设计不合理 |
确认引物无自身互补,或两条引物不互补,尤其在近3'端 |
| 检查PCR引物的长度和Tm |
| 避免在引物的3'端使用3个连续的G或C |
体系被另一目的RNA/DNA污染 |
加样时使用正排式移液管、气阻枪头以减少交叉污染 |
| 在扩增前或扩增后分别应用独立的操作区域和加样器 |
| 戴手套并经常更换 |
| 采用UNG或其它灭菌方法来防止DNA遗留到后续反应中 |
Oligo DNA和模板非特异性
在第一链合成中使用GSP,而不是随机Oligo DNA或Oligo(dT)
退火 |
在第一链合成中使用GSP,而不是随机Oligo DNA或Oligo( |
| 


